Πρόκειται για τη νέα εποχή στην θεραπεία ανίατων – μέχρι τώρα – ασθενειών. Κατά πολλούς αποτελεί το «Άγιο Δισκοπότηρο» της γενετικής και θα μπορούσε να εξελιχθεί σε μια επανάσταση που θα ορίσει τον 21ο αιώνα. Το σίγουρο είναι πως το CRISPR, η τεχνολογία γονιδιακής επεξεργασίας, βρίσκεται ήδη εδώ με αμέτρητες δυνατότητες που ανοίγουν νέους ορίζοντες για την ανθρωπότητα.
Ας σκεφτούμε δύο σενάρια. Από τη μια έχουμε έναν άνθρωπο που αντιμετωπίζει μια κληρονομική ασθένεια, πιθανότατα και θανατηφόρα. Η γονιδιακή τροποποίηση θα μπορούσε να τον σώσει οριστικά. Χάρη στην τεχνική CRISPR, οι επιστήμονες στοχεύουν συγκεκριμένες θέσεις στο DNA του ασθενούς, το τροποποιούν, το επιδιορθώνουν και τελικά θεραπεύουν τον ασθενή. Από την άλλη έχουμε το σενάριο της γονιδιακής τροποποίησης ενός αγέννητου μωρού, ώστε να αντιστραφεί μια σπάνια διαταραχή πριν ακόμη αυτή ξεκινήσει.
Το πρώτο σενάριο ήδη εφαρμόζεται σε πολλά μέρη του κόσμου με τα αποτελέσματα να είναι σπουδαία, αν και παραμένει μια τρομερά ακριβή θεραπεία για πολύ λίγους. Το δεύτερο σενάριο θεωρείται απαγορευμένο από τις περισσότερες αρχές ανά τον κόσμο.
Ο «Δρ Φρανκεστάιν»

Το 2018 η υπόθεση του κινέζου γενετιστή Χε Τζιανκούι είχε γίνει πρωτοσέλιδο σε όλο τον κόσμο, καθώς είχε ανακοινώσει τη γενετική τροποποίηση των εμβρύων δίδυμων κοριτσιών για να είναι ανθεκτικά στον ιό HIV. Ο γενετιστής, τον οποίο πολλοί αποκάλεσαν «Δρ Φράνκεστάιν», φυλακίστηκε για τρία χρόνια, όμως η αποκάλυψή του αναγνωρίστηκε ως η αυλαία μιας νέα εποχής στην οποία δίνεται η δυνατότητα επεξεργασίας του γενετικού κώδικα για την τροποποίηση του σώματός μας.
Οι προκλήσεις και το μέλλον μιας τεχνολογίας, που γοητεύει αλλά και τρομάζει, τέθηκαν στο τραπέζι των επιστημόνων τον Μάρτιο στη Διεθνή Σύνοδο Επεξεργασίας Ανθρώπινου Γονιδιώματος που διοργανώθηκε στο Λονδίνο. Οι έρευνες για τις θεραπείες με γενετική τροποποίηση συνεχίζονται και το ερώτημα είναι τι ακολουθεί στον τομέα της γονιδιακής επεξεργασίας. Θα μπορούσαμε να εξαλείψουμε ασθένειες που παλαιότερα αναγνωρίζονταν ως ανίατες; Και τελικά πόσο ασφαλείς θα είναι τέτοιες θεραπείες;
Κοπτοραπτική γονιδιώματος
Tο CRISPR – η τεχνολογία γονιδιακής επεξεργασίας – αναπτύχθηκε από τις ερευνήτριες Τζένιφερ Ντούντνα (Jennifer Doudna) και Εμανουέλ Σαρπεντιέ (Emmanuelle Charpentier), οι οποίες κέρδισαν το βραβείο Νόμπελ το 2020 για το επίτευγμά τους. Το CRISPR λειτουργεί ως μοριακό ψαλίδι «κόβοντας και ράβοντας» το γονιδίωμα. Στις πιο σύγχρονες μεθόδους πολλοί περιγράφουν τη διαδικασία ως «μολύβι και γόμα», δίνοντας τη δυνατότητα στους επιστήμονες να σβήνουν και να ξαναγράφουν το γονιδίωμα. Οι εξελίξεις στην επεξεργασία του γονιδιώματος θα μπορούσαν να διευρύνουν δραματικά το πεδίο εφαρμογής και το CRISPR θα μπορούσε ενδεχομένως να βοηθήσει στη θεραπεία πολύ περισσότερων παθήσεων.
Όπως αναφέρει το MIT Technology Review, η πρώτη γενιά τεχνικής CRISPR ουσιαστικά κόβει το DNA. Στη συνέχεια, τα κύτταρα επιδιορθώνουν την περιοχή εγκοπής και η διαδικασία αυτή συνήθως προστατεύει από μια επιβλαβή γενετική μετάλλαξη. Οι νεότερες μορφές της τεχνολογίας CRISPR λειτουργούν με ελαφρώς διαφορετικούς τρόπους. Για παράδειγμα, ο επεξεργαστής βάσεων, γνωστός ως CRISPR 2.0, στοχεύει και μετατρέπει τα βασικά δομικά στοιχεία του DNA. Υπάρχει επίσης και η τεχνική prime editing, ή CRISPR 3.0, η οποία επιτρέπει στους επιστήμονες να αντικαθιστούν ολόκληρα τμήματα DNA ή να εισάγουν νέα κομμάτια γενετικού κώδικα.
Οι δυνατότητες φαίνεται πως είναι απεριόριστες όμως το να γίνουν αυτές οι θεραπείες γονιδιακής επεξεργασίας προσιτές και προσβάσιμες σε περισσότερους παραμένει μια τεράστια πρόκληση, ενώ ταυτόχρονα κρίσιμα ερωτήματα ηθικής φύσης, αλλά και ασφάλειας εξακολουθούν να αναζητούν σοβαρές απαντήσεις.
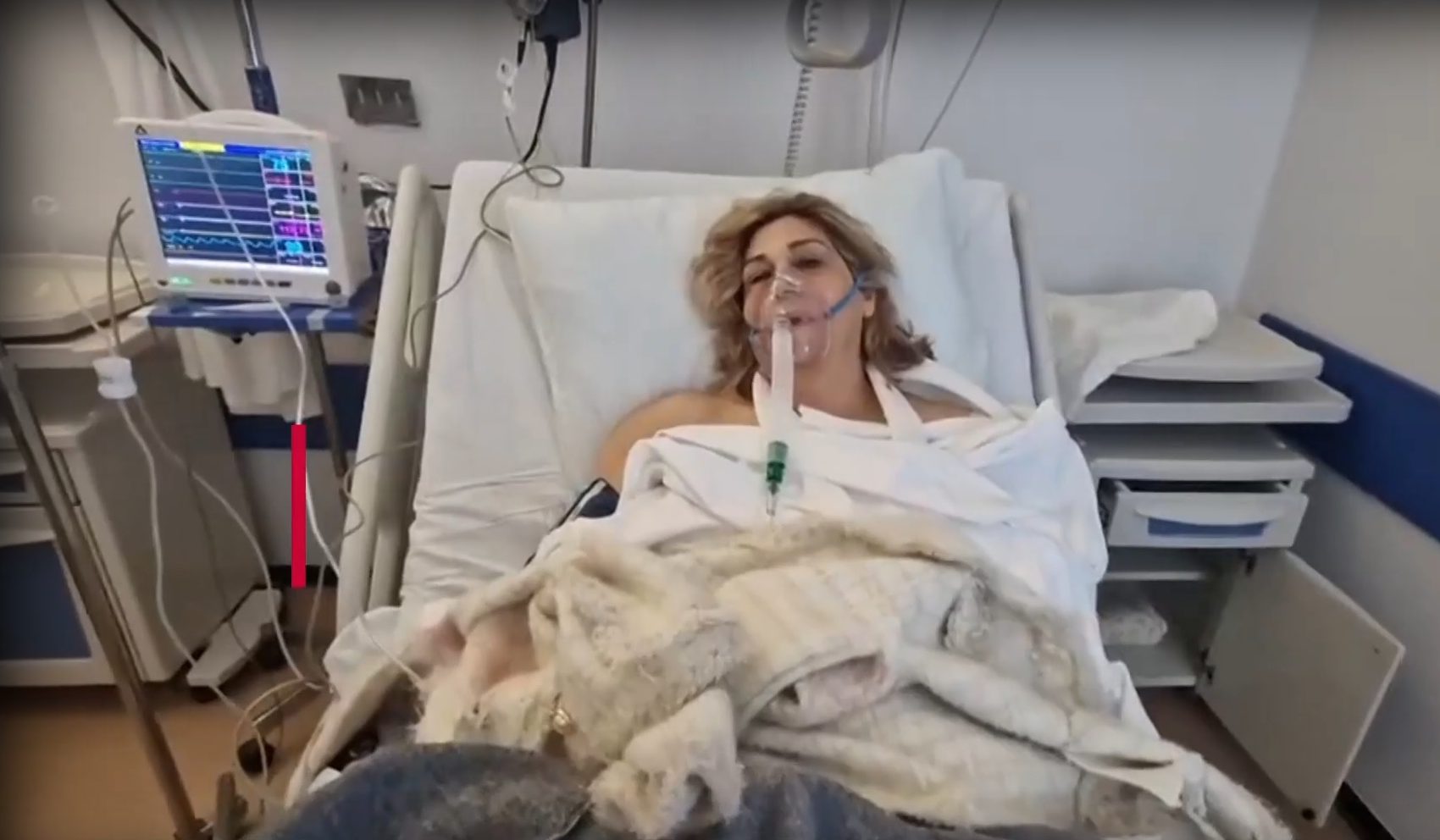
Ήδη θεραπείες που χρησιμοποιούν την τεχνική CRISPR ελέγχονται σε κλινικές δοκιμές με ανθρώπους. Αυτή την περίοδο εκατοντάδες νέες δοκιμές για τη διόρθωση σφαλμάτων στο ανθρώπινο γονιδίωμα βρίσκονται σε εξέλιξη. Στο συνέδριο στο Λονδίνο, παρουσιάστηκε η ιστορία της Βικτώρια Γκρέι, μιας γυναίκας που συμμετείχε σε κλινική δοκιμή για τη θεραπεία της δρεπανοκυτταρικής αναιμίας. Αυτή η γενετική ασθένεια επηρεάζει εκατομμύρια ανθρώπους στο κόσμο και προκαλείται από μια μόνο μετάλλαξη στο ανθρώπινο DNA. Μέχρι σήμερα οι ασθενείς αναζητούσαν παρηγοριά σε παυσίπονα, ωστόσο το επόμενο διάστημα στις ΗΠΑ αναμένεται να εγκριθεί η πρώτη θεραπεία με επεξεργασία γονιδιώματος.
Τεράστια τεχνολογικά, οικονομικά και ηθικά ζητήματα
Και οι εν λόγω θεραπείες για σοβαρές σπάνιες διαρκώς αυξάνονται. Συνεχίζουν ωστόσο να κοστίζουν τεράστια ποσά γεγονός που τις καθιστούν μη εφαρμόσιμες για το ευρύ κοινό, αλλά ακόμα και μη συμφέρουσες για τις μεγάλες εταιρείες έρευνας. Για να αλλάξει αυτό θα πρέπει να ξεπεραστούν πολλά τεχνολογικά, οικονομικά και ρυθμιστικά εμπόδια, αν και η πρόοδος σε όλους τους τομείς είναι αρκετά γρήγορη.
Ένα από τα πιο κρίσιμα ζητήματα που υπογραμμίζουν οι γενετιστές είναι το γεγονός πως η γονιδιακή τροποποίηση αλλάζει μια για πάντα τον οργανισμό. Τροποποιεί τον τρόπο με τον οποία ένα σώμα παράγει κύτταρα και αυτό διαρκεί για μια ζωή. Για πολλούς αυτό αποτελεί έναν μεγάλο εφιάλτη, καθώς αν έχει επεξεργαστεί έναν οργανισμό δεν μπορείς έτσι απλά να αναιρέσεις την αλλαγή. Για αυτό και πολλοί γενετιστές, όπως επισημαίνει το Al Jazeera, σε δημοσίευμά του, είναι τρομερά επιφυλακτικοί σχετικά με την εφαρμογή τέτοιων θεραπειών. «Το CRISPR θα πρέπει να χρησιμοποιηθεί αποκλειστικά όπου δεν υπάρχουν άλλες θεραπευτικές επιλογές», τονίζουν.
Επίσης οι εταιρείες φαρμάκων, οι ασφαλιστές και οι ρυθμιστικές αρχές δεν έχουν ακόμη σαφή μοντέλα για το πώς να τιμολογούν τις εφάπαξ θεραπείες που κοστίζουν τεράστια ποσά και εξυπηρετούν μικρές ομάδες ασθενών. Οι περισσότεροι επιστήμονες επιμένουν ότι το πεδίο απλά δεν είναι έτοιμο για μερικές από τις πιο εκτεταμένες προσεγγίσεις που θεωρητικά είναι δυνατές.
Και οι κίνδυνοι είναι πολλαπλοί: Πώς λειτουργεί ένα γονίδιο στα πολλά στάδια ανάπτυξης; Πώς λειτουργεί κατά τη διάρκεια μιας ζωής; Τι γίνεται αν μια τροποποίηση χάσει τον στόχο της; Τι γίνεται αν κάποια κύτταρα επηρεάζονται ενώ άλλα όχι; Μέχρι να γίνουν αντιληπτά τα αρνητικά αποτελέσματα, και αφού πρώτα μερικά κύτταρα έγιναν τρισεκατομμύρια, θα υπάρχει η δυνατότητα νέας παρέμβασης ή θα είναι πολύ αργά;

Οποιαδήποτε νέα θεραπεία πρέπει να είναι τουλάχιστον εξίσου ασφαλής με τις ήδη διαθέσιμες, τονίζει η Τάνια Μπουμπέλα, που μελετά τις νομικές και ηθικές επιπτώσεις των νέων τεχνολογιών, στο Πανεπιστήμιο Simon Fraser στο Burnaby της Βρετανικής Κολομβίας. «Πολλά φάρμακα έχουν παρενέργειες. Η διαφορά είναι ότι η φαρμακευτική αγωγή ενός ασθενούς μπορεί να αλλάξει. Με την γονιδιακή επεξεργασία όμως, δεν μπορώ να φανταστώ πώς θα μπορούσε να γίνει αυτό», σημείωσε, σύμφωνα με το MIT Technology Review.
Η τιμή και η ασφάλεια οποιασδήποτε θεραπείας γονιδιακής επεξεργασίας θα καθορίσουν αν μπορεί πραγματικά να βοηθήσει όλο τον κόσμο, πρόσθεσε η ερευνήτρια, ενώ ο Αλέξις Κόμορ από το Πανεπιστήμιο της Καλιφόρνιας στο Σαν Ντιέγκο, ο οποίος ανέπτυξε μερικές από τις νεότερες τεχνικές CRISPR, υπογραμμίζει με νόημα: «Υπάρχει ένας καλός λόγος που οι πρώτες δοκιμές του CRISPR επικεντρώθηκαν σε άτομα με σπάνιες διαταραχές που έχουν λίγες επιλογές».